 Главным лечебным компонентом медного купороса (CuSO4 Х 5H2O) являются ионы меди, пагубно влияющие на возбудителей большинства грибных болезней, а также на насекомых-вредителей садовых культур. Может использоваться в качестве микроудобрения для восполнения дефицита меди в почве.
Главным лечебным компонентом медного купороса (CuSO4 Х 5H2O) являются ионы меди, пагубно влияющие на возбудителей большинства грибных болезней, а также на насекомых-вредителей садовых культур. Может использоваться в качестве микроудобрения для восполнения дефицита меди в почве.
Медный купорос применяется в виде водного раствора, который является достаточно кислым для уничтожения любых живых клеток, а потому и растения, в том числе, могут получить ожог.В связи с этим, для листовой (внекорневой) обработки лучше использовать Бордосскую жидкость-смесь водного раствора медного купороса и гашеной извести, в которой кислота нейтрализована, а лечебное воздействие самого купороса на растения и почву сохраняется. Благодаря достаточно высокой эффективности, хорошей наглядности обработок, удерживаемости на листьях и щадящему воздействием на растения, Бордосская жидкость пользуется большой популярной среди потребителей.
Раствор Бордосской смеси рекомендуют использовать в двух вариантах:
1. Ранневесеннее ("голубое") опрыскивание плодовых деревьев, когда их почки не распустились полностью и находятся еще в состоянии покоя (3-4%-раствор).
2. Опрыскивание во время вегетации растений (1%-раствор).
Чтобы достичь максимально высокого эффекта Бордосской жидкости, следует обратить внимание на особенности ее приготовления.
Для приготовления 10 л 1%-жидкости: 100 г порошкообразного медного купороса растворяют в небольшом объеме горячей воды (не выше 50°С), затем общий объем раствора доводят до 9 литров.
В другой емкости растворяют 100-150 г извести в небольшом количестве холодной воды, добавляя ее малыми порциями, до получения однородной сметанообразной массы.
Общий объем известкового молока доводится до 1 л.
На следующем этапе раствор медного купороса медленно, при постоянном помешивании, вливают тонкой струйкой в предварительно отфильтрованное известковое молоко (оба раствора до соединения должны быть холодными).
Если порядок смешивания растворов при этом рецепте изменить, то есть известковое молоко влить в раствор медного купороса, то качество препарата будет низким.
Нельзя также смешивать крепкие растворы этих компонентов, а также вливать крепкий раствор медного купороса в слабый раствор известкового молока. В этих случаях образуются сферические кристаллы, которые легко смываются осадками.
В работе следует использовать деревянную, стеклянную или глиняную емкость (металлическая посуда для этих целей не пригодна).
Бордосскую смесь готовят непосредственно перед использованием. Ее нельзя хранить более суток, так как позже компоненты препарата выпадают в осадок и кристаллизуются, а смесь становится непригодной для применения.
При правильном приготовлении жидкость должна быть голубого цвета. Она характеризуется стабильностью суспензии, нейтральной или слабощелочной реакцией (последнее предпочтительнее). Определить реакцию Бордоской смеси можно с помощью лакмусовой бумажки. При ее отсутствии в раствор опускают чистую железную проволоку или гвоздь (на 1-1,5 мин.). Если железный предмет покрывается красным налетом, значит реакция кислая и в раствор следует добавить еще известковое молоко.
Средство не совместимо с другими препаратами и применяется отдельно.
При приготовлении 3%-раствора Бордосской жидкости для "голубого" опрыскивания на 300 г медного купороса берут 400 г извести. Его применяют на яблоне, груше, айве против парши, пятнистости листьев; на сливе, вишне, черешне против коккомикоза, кластероспориоза, курчавости, монилиоза; на смородине, крыжовнике, малине и землянике против пятнистостей листьев.
Использование 1%- Бордосской жидкости в период вегетации.
– На яблоне, груше — против парши, филлостиктоза, монилиоза и других пятнистостей листьев.
В борьбе с паршой яблони и груши первая обработка проводится при порозовении бутонов, вторая — после цветения и последующие — через 10-18 дней по мере необходимости.
– На сливе и черешне — против пятнистостей листьев кластероспориоза, курчавости, коккомикоза, монилиоза (не более четырех обработок).
– На кустах смородины и крыжовника — против поражения листьев антракнозом, септориозом и ржавчиной (2-3 обработки).
– На малине и землянике — против пятнистостей листьев (до цветения и после сбора урожая).
– На картофеле, томатах открытого и защищенного грунта — против грибных и ряда бактериальных болезней.
– На огурцах открытого и закрытого грунта, дыне и арбузах — против антракноза, оливковой пятнистости, бактериоза.
– На свекле (сахарная, столовая, кормовая) — от пероноспороза (ложная мучнистая роса), церкоспороза, ржавчины.
– На луке — от пероноспороза, ржавчины и гнилей (3 обработки).
– На цветочных растениях и декоративных кустарниках- от ржавчины, различных пятнистостей и других болезней (обработка до и после цветения).
Бордоская смесь примечательна и тем, что находит широкое применение в садовом хозяйстве и после уборки урожая.
Смесь мало опасна для полезных насекомых и пчел, но во время опрыскивания и в последующие 5-6 часов, пчел лучше изолировать от обработанных растений.
Обработку не следует проводить при высокой росе и в те дни, когда возможны атмосферные осадки.
Использование Бургундской жидкости
Бургундская жидкость – водный раствор медного купороса (сульфата меди) и кальцинированной (не путать с питьевой) соды (карбоната натрия, Na2CO3).
Применяется для борьбы с грибковыми заболеваниями фруктовых деревьев, ягодных и цветочных культур, предотвращает такие проявления, как хлороз, деформации, белый и серый налет, пятнистости, засыхание и опадение листьев, некрозы.
Правильно приготовленный препарат, не препятствует фотосинтезу, равномерно покрывает чувствительные части растений защитным слоем.
Особенно практично «бургундской смесью» обрабатывать цветы, поскольку растения не «белятся» так интенсивно, как при использовании «бургундской жидкости», в результате чего сохраняется привлекательный товарный вид.
Чаще всего применяется 1% раствор «бургундской жидкости». Для приготовления 10 литров состава смешивают сульфат меди и кальцинированную соду в следующей последовательности:
1. Нагреть воду до 40-45 °C;
2. Растворить 100 г. медного купороса в 5 литрах воды, а в остальных 5 литрах 125 г. кальцинированной соды;
3. Тонкой струйкой влить раствор соды в раствор медного купороса.
Не используйте слишком сильный концентрат!
Используйте сразу же приготовленный раствор, так как «бургундская жидкость» не хранится долго и быстро теряет свои качества.
Использование водного раствора сульфата меди.
В качестве удобрения.
Его использование 1 раз в 5-6 лет ранней весной или осенью будет целесообразным, в частности, на торфяниках, где может иметь место недостаток меди в грунте.
Расход: 1 г на 1 м2. Перед применением средство необходимо хорошо измельчить и смешать с землей.
Для внекорневой подкормки вегетирующих растений доза: 1-2 г медного купороса на 10 л воды.
Для дезинфекции путем опускания в раствор на 3 мин., с обильной последующей промывкой водой.
– Корней саженцев — после удаления наростов корневого бактериального рака;
– черенков крыжовника, смородины отпрысков малины- против антракноза, мучнистой американской росы;
– усов земляники (клубники) против мучнистой росы;
– надземных частей крыжовника, смородины после обрезки больных частей — против мучнистой американской росы.
Расход: 100 г — 10 л воды
Для дезинфекции почвы путем полива.
-Против черной ножки капусты, томата; серой и белой гнили томата; фузариоза или желтизны капусты, редиса, репы, брюквы.
Расход: 5 г – 10 л воды.
Для дезинфекции ран плодовых деревьев.
— Применяется водный раствор из расчета: 100 г на 10 л воды;
Для борьбы с корневым бактериальным раком у плодовых и роз применяется погружение корневой после удаление наростов на 2-3 минуты в 1% раствор с последующим промыванием их водой.
Для опрыскивания перед посадкой:
-Клубней картофеля — против фитофтороза.
Расход: 2 г – 10 л воды.
Для опрыскивания в период вегетации.
— Томата, картофеля-против фитофтороза.
Расход: 20 г – 10 л воды
Обработка теплиц.
Все деревянные поверхности, инвентарь, ящики нужно обработать 10% раствором медного купороса. Особенно это актуально, если нужно избавиться от фитофторы. Через две недели дезинфекцию теплицы желательно повторить.
Побелка деревьев.
Производится осенью и весной.
Состав побелки:10 литров воды, 200-300 г медного(железного) купороса, 2-2,5 кг гашенной извести или мела.
Во время работы соблюдайте общие требования безопасности и правила личной гигиены, пользуйтесь перчатками, очками, респиратором или ватно-марлевой повязкой.
После работы следует вымыть руки и лицо с мылом, прополоскать рот.
Купить сульфат меди (медный купорос, сернокислая медь) в Минске по доступной цене от литовской компании MKDS вы можете связавшись с нашими специалистами.
Магнитное поле Земли ежегодно ослабевает на 0,05% и если это будет продолжаться, то через ещё 2000 лет компас перестанет работать.
—>СТАТИСТИКА —>
—>МЫ ВКОНТАКТЕ —>
—>НЕМНОГО РЕКЛАМЫ —>
Наши спонсоры

Описание:
Концентрированная серная кислота (H2SO4) не растворяет кристаллы медного купороса (CuSO4·5H2O), но при ее участии происходят странные события. Если в пробирку с концентрированной серной кислотой бросить голубой кристалл медного купороса, то он будет постепенно обесцвечиваться.
Дело в том, что концентрированная серная кислота обладает феноменальной способностью поглощать влагу, она может отрывать молекулы воды от многих соединений и образовывать гидраты, в которых на одну молекулу H2SO4 будут приходиться одна, две, три, четыре и даже шесть молекул воды.
Обесцвечивание кристаллов медного купороса вызвано тем, что серная кислота отнимает входящие в его состав молекулы воды:
| Сульфат меди | |
|---|---|
 |
|
 |
|
| Общие | |
| Систематическое наименование |
сульфат меди(II) |
| Традиционные названия | пентагидрат: медный купорос |
| Хим. формула | Cu S O 4 |
| Физические свойства | |
| Состояние | кристаллическое |
| Молярная масса | 159,609 (сульфат) 249.685 (пентагидрат) г/моль |
| Плотность | 3,64 г/см³ |
| Твёрдость | 2,5 [1] |
| Термические свойства | |
| Т. разл. | выше 650 °C |
| Химические свойства | |
| pKa | 5⋅10 −3 |
| Структура | |
| Координационная геометрия | Октаэдрическая |
| Кристаллическая структура | безв. — ромбическая пентагидрат — триклинная пинакоидальная тригидрат — моноклинная |
| Классификация | |
| Рег. номер CAS | 7758-98-7 |
| PubChem | 24462 |
| Рег. номер EINECS | 231-847-6 |
| SMILES | |
| Кодекс Алиментариус | E519 |
| RTECS | GL8800000 |
| ChEBI | 23414 |
| ChemSpider | 22870 |
| Безопасность | |
| ПДК | в воздухе: мр 0,009, сс 0,004; в воде: 0,001 |
| ЛД50 |
крысы, орально [2] : 612,9 мг/кг мыши, орально: 87 мг/кг |
| Токсичность | |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Сульфа́т ме́ди(II) (медь серноки́слая, ме́дный купоро́с) — неорганическое соединение, медная соль серной кислоты с формулой Cu S O 4. Нелетучее вещество, не имеет запаха. В безводном виде — белый порошок, очень гигроскопичное. В виде кристаллогидратов — прозрачные негигроскопичные кристаллы различных оттенков синего с горьковато-металлическим вяжущим вкусом, на воздухе постепенно выветриваются (теряют кристаллизационную воду).
Сульфат меди(II) хорошо растворим в воде. Из водных растворов кристаллизуется голубой пентагидрат CuSO4·5H2O — медный купоро́с. Токсичность медного купороса для теплокровных животных относительно невысока, в то же время, он высокотоксичен для рыб.
Обладает дезинфицирующими, антисептическими, вяжущими свойствами. Применяется в медицине, в растениеводстве как антисептик, фунгицид или медно-серное удобрение.
Реакция гидратации безводного сульфата меди(II) экзотермическая и проходит со значительным выделением тепла.
Содержание
Нахождение в природе [ править | править код ]
Получение [ править | править код ]
В промышленности [ править | править код ]
В промышленности загрязнённый сульфат меди(II) получают растворением меди и медных отходов в разбавленной серной кислоте H2SO4 при продувании воздуха:
2 C u + O 2 + 2 H 2 S O 4 → 2 C u S O 4 + 2 H 2 O , <displaystyle <mathsf <2Cu+O_<2>+2H_<2>SO_<4>
ightarrow 2CuSO_<4>+2H_<2>O>>,>
C u O + H 2 S O 4 → C u S O 4 + H 2 O , <displaystyle <mathsf <2>SO_<4>
ightarrow CuSO_<4>+H_<2>O>>,>
сульфатизирующим обжигом сульфидов меди и как побочный продукт электролитического рафинирования меди.
В лабораторных условиях [ править | править код ]
В лаборатории CuSO4 можно получить действием концентрированной серной кислоты на медь при нагревании:
C u + 2 H 2 S O 4 → C u S O 4 + S O 2 ↑ + 2 H 2 O , <displaystyle <mathsf <2>SO_<4>
ightarrow CuSO_<4>+SO_<2>uparrow +2H_<2>O>>,>
температура не должна превышать 60 °С, при большей температуре в значительных количествах образуется побочный продукт — сульфид меди(I):
5 C u + 4 H 2 S O 4 → 3 C u S O 4 + C u 2 S ↓ + 4 H 2 O . <displaystyle <mathsf <5Cu+4H_<2>SO_<4>
ightarrow 3CuSO_<4>+Cu_<2>Sdownarrow +4H_<2>O>>.>
Также в лабораторных условиях сульфат меди (II) может быть получен реакцией нейтрализации гидроксида меди(II) серной кислотой, для получения сульфата меди высокой чистоты используют соответственно чистые реактивы:
C u ( O H ) 2 + H 2 S O 4 → C u S O 4 + 2 H 2 O . <displaystyle <mathsf <2>+H_<2>SO_<4>
ightarrow CuSO_<4>+2H_<2>O>>.>
Чистый сульфат меди может быть получен следующим образом. В фарфоровую чашку наливают 120 мл дистиллированной воды, прибавляют 46 мл химически чистой серной кислоты плотностью 1,8 г/см 3 и помещают в смесь 40 г чистой меди (например, электролитической). Затем нагревают до 70—80 °С и при этой температуре в течение часа постепенно, порциями по 1 мл, прибавляют 11 мл конц. азотной кислоты. Если медь покроется кристаллами, прибавить 10—20 мл воды. Когда реакция закончится (прекратится выделение пузырьков газа), остатки меди вынимают, а раствор упаривают до появления на поверхности плёнки кристаллов и дают остыть. Выпавшие кристаллы следует 2—3 перекристаллизовать из дистиллированной воды и высушить [4] .
Очистка [ править | править код ]
Очистить загрязнённый или технический сульфат меди можно перекристаллизацией — вещество растворяется в кипящей дистиллированной воде до насыщения раствора, после чего охлаждается до приблизительно +5 °С. Полученный осадок кристаллов отфильтровывается. Однако даже многократная перекристаллизация не позволяет избавиться от примеси соединений железа, которые являются наиболее распространённой примесью в сульфате меди.
Для полной очистки медный купорос кипятят с диоксидом свинца PbO2 или пероксидом бария BaO2, пока отфильтрованная проба раствора не покажет отсутствия железа. Затем раствор фильтруют и упаривают до появления на поверхности плёнки кристаллов, после чего охлаждают для кристаллизации [4] .
По Н. Шоорлю очистить сульфат меди можно так: к горячему раствору CuSO4 прибавить небольшие количества пероксида водорода H2O2 и гидроксида натрия NaOH, прокипятить и отфильтровать осадок. Выпавшие из фильтрата кристаллы дважды подвергаются перекристаллизации. Полученное вещество имеет чистоту не ниже квалификации «ХЧ» [4] .
Глубокая очистка [ править | править код ]
Существует более сложный способ очистки, позволяющий получить сульфат меди особой чистоты, с содержанием примесей около 2·10 -4 %.
Для этого готовится водный, насыщенный при 20°С раствор сульфата меди (вода используются только бидистиллированная). В него добавляют перекись водорода в количестве 2-3 мл 30 % раствора на 1 литр, перемешивают, вносят свежеосаждённый основной карбонат меди в количестве 3-5 грамм, нагревают и кипятят 10 минут для разложения H2O2.
Затем раствор охлаждают до 30—35 °С, фильтруют и приливают 15 мл 3%-ного раствора диэтилдитиокарбамата натрия и выдерживают в мешалке три-четыре часа не понижая температуры. Далее раствор быстро процеживают от крупных хлопьев комплексов и вносят активированный уголь БАУ-А на полчаса при перемешивании. Затем раствор следует отфильтровать вакуумным методом.
Дальше в раствор CuSO4 приливают на 1 л около 200 мл насыщенного раствора NaCl квалификации «Ч» и вносят чистый алюминий в проволоке или обрезках до полного прохождения реакции, выделения меди и просветления раствора (при этом выделяется водород). Выделенную медь отделяют от алюминия взбалтыванием, осадок промывают декантацией сперва водой затем заливают горячим 5—10 % раствором соляной кислоты ХЧ при взбалтывании в течение часа и постоянным подогревом до 70—80 °С, затем промывают водой и заливают 10—15%-ной серной кислотой (ОСЧ 20-4) на час с подогревом при том же интервале температур. От степени и тщательности промывания кислотами, а также квалификации применяемых далее реактивов зависит чистота дальнейших продуктов.
После промывки кислотами медь снова моют водой и растворяют в 15—20%-ной серной кислоте (ОСЧ 20-4) без её большого избытка с добавлением перекиси водорода (ОСЧ 15-3). После прохождения реакции полученный кислый раствор сульфата меди кипятят для разложения избытка перекиси и нейтрализуют до полного растворения вначале выпавшего осадка перегнанным 25%-ным раствором аммиака (ОСЧ 25-5) или приливают раствор карбоната аммония, очищенного комплексно-адсорбционным методом до особо чистого.
После выстаивания в течение суток раствор медленно фильтруют. В фильтрат добавляют серную кислоту (ОСЧ) до полного выпадения голубовато-зелёного осадка и выдерживают до укрупнения и перехода в зелёный основной сульфат меди. Зелёный осадок выстаивают до компактности и тщательно промывают водой до полного удаления растворимых примесей. Затем осадок растворяют в серной кислоте, фильтруют, устанавливают рН=2,5—3,0 и перекристаллизовывают два раза при быстром охлаждении, причем при охлаждении раствор каждый раз перемешивают для получения более мелких кристаллов сульфата меди. Выпавшие кристаллы переносят на воронку Бюхнера и удаляют остатки маточного раствора с помощью водоструйного насоса. Третья кристаллизация проводится без подкисления раствора с получением чуть более крупных и оформленных кристаллов [5] .
Физические свойства [ править | править код ]
Пентагидрат сульфата меди(II) (медный купорос) — синие прозрачные кристаллы триклинной сингонии. Плотность 2,284 г/см 3 . При температуре 110 °С отщепляется 4 молекулы воды, при 150 °С происходит полное обезвоживание [6] .
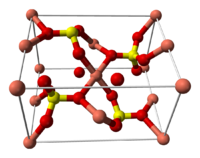
Строение кристаллогидрата [ править | править код ]
Структура медного купороса приведена на рисунке. Как видно, вокруг иона меди координированы два аниона SO4 2− по осям и четыре молекулы воды (в плоскости), а пятая молекула воды играет роль мостиков, которые при помощи водородных связей объединяют молекулы воды из плоскости и сульфатную группу.

Термическое воздействие [ править | править код ]
При нагревании пентагидрат последовательно отщепляет две молекулы воды, переходя в тригидрат CuSO4·3H2O (этот процесс, выветривание, медленно идёт и при более низких температурах [в том числе при 20—25 °С]), затем в моногидрат (при 110 °С) CuSO4·H2O, и выше 258 °C образуется безводная соль.
Выше 650 °C становится интенсивным пиролиз безводного сульфата по реакции:
2 C u S O 4 → o t 2 C u O + 2 S O 2 + O 2 <displaystyle <mathsf <2CuSO_<4><xrightarrow[<>]<^
Растворимость [ править | править код ]
Растворимость сульфата меди(II) по мере роста температуры проходит через плоский максимум, в течение которого растворимость соли почти не меняется (в интервале 80—200 °C). (см. рис.)
Как и все соли, образованные ионами слабого основания и сильной кислоты, сульфат меди(II) гидролизуется, (степень гидролиза в 0,01 М растворе при 15 °C составляет 0,05 %) и даёт кислую среду (pH указанного раствора 4,2). Константа диссоциации составляет 5⋅10 −3 .
Химические свойства [ править | править код ]
Электролитическая диссоциация [ править | править код ]
CuSO4 — хорошо растворимая в воде соль и сильный электролит, в растворах сульфат меди(II) так же, как и все растворимые соли, диссоциирует в одну стадию:
C u S O 4 → C u 2 + + S O 4 2 − . <displaystyle <mathsf <4>
ightarrow Cu^<2+>+SO_<4>^<2->>>.>
Реакция замещения [ править | править код ]
Реакция замещения возможна в водных растворах сульфата меди с использованием металлов активнее чем медь, стоящих левее меди в электрохимическом ряду напряжения металлов:
C u S O 4 + Z n → C u ↓ + Z n S O 4 . <displaystyle <mathsf <4>+Zn
ightarrow Cudownarrow +ZnSO_<4>>>.>
Реакция с растворимыми основаниями (щелочами) [ править | править код ]
Сульфат меди(II) реагирует с щелочами с образованием осадка гидроксида меди(II) голубого цвета [7] :
C u S O 4 + 2 K O H → C u ( O H ) 2 ↓ + K 2 S O 4 <displaystyle <mathsf <4>+2KOH
ightarrow Cu(OH)_<2>downarrow +K_<2>SO_<4>>>> 
ightarrow Cu(OH)_<2>downarrow +Li_<2>SO_<4>>>> 
ightarrow Cu(OH)_<2>downarrow +Na_<2>SO_<4>>>>
Сокращённое ионное уравнение (Правило Бертолле) [ править | править код ]
Реакция обмена с другими солями [ править | править код ]
Сульфат меди вступает также в обменные реакции по ионам Cu 2+ и SO4 2-
C u S O 4 + B a C l 2 → C u C l 2 + B a S O 4 ↓ <displaystyle <mathsf <4>+BaCl_<2>
ightarrow CuCl_<2>+BaSO_<4>downarrow >>> 
ightarrow CuSdownarrow +K_<2>SO_<4>>>>
Прочее [ править | править код ]
С сульфатами щелочных металлов и аммония образует комплексные соли, например, Na2[Cu(SO4)2]·6H2O.
Ион Cu 2+ окрашивает пламя в зелёный цвет.
Производство и применение [ править | править код ]



Сульфат меди(II) — один из важнейших солей меди. Часто служит исходным сырьём для получения других соединений меди.
Безводный сульфат меди — хороший влагопоглотитель и может быть использован для абсолютирования этанола, осушения газов (в том числе воздуха) и как индикатор влажности.
Лёгкость выращивания кристаллов пентагидрата сульфата меди и их резкое различие с безводной формой используются в школьном образовании.
В строительстве водный раствор сульфата меди применяется для нейтрализации последствий протечек, ликвидации пятен ржавчины, а также для удаления выделений солей («высолов») с кирпичных, бетонных и оштукатуренных поверхностей, а также как антисептическое и фунгицидное средство для предотвращения гниения древесины.
В сельском хозяйстве медный купорос применяется как антисептик, фунгицид и медно-серное удобрение. Для обеззараживания ран деревьев используется 1%-ный раствор (100 г на 10 л), который втирается в предварительно зачищенные повреждённые участки. Против фитофтороза томатов и картофеля производятся опрыскивания посадок 0,2 % раствором (20 г на 10 л) при первых признаках заболевания, а также для профилактики при угрозе возникновения болезни (например, в сырую влажную погоду). Раствором сульфата меди поливается почва для обеззараживания и восполнения недостатка серы и меди (5 г на 10 л). Однако чаще медный купорос применяется в составе бордо́ской жидкости — основного сульфата меди CuSO4·3Cu(OH)2 против грибковых заболеваний и виноградной филлоксеры. Для этих целей сульфат меди(II) имеется в розничной торговле.
Для борьбы с цветением воды в водохранилищах также используется химическая обработка медным купоросом [8] .
Также он применяется для изготовления минеральных красок, в медицине, как один из компонентов электролитических ванн для меднения и т. п. и в составе прядильных растворов в производстве ацетатного волокна.
В пищевой промышленности зарегистрирован в качестве пищевой добавки E519. Используется как фиксатор окраски и консервант.
В быту применяют для выведения пятен ржавчины на потолке после затоплений.
В пунктах скупки лома цветных металлов раствор медного купороса применяется для выявления цинка, марганца и магния в алюминиевых сплавах и нержавейке. При выявлении этих металлов появляются красные пятна.
Токсикология [ править | править код ]
Сульфат меди(II) является соединением с умеренной токсичностью и относится к классу опасности 4 (малоопасное вещество). Смертельная доза медного купороса составляет от 45 до 125 граммов для взрослого человека перорально (при проглатывании), в зависимости от массы, состояния здоровья, иммунитета к избытку меди и от других факторов. Признаки отравления становится заметным при разовом потреблении более 0,5 г соединения внутрь (т. н. токсическая доза). LD50 для крыс 612,9 мг/кг [2] . Картина отравления при вдыхании аэрозолей более сложна.
Попадание на кожу сухого вещества безопасно, но его необходимо смыть. Аналогично при попадании растворов и увлажнённого твердого вещества. При попадании в глаза необходимо обильно промыть их проточной водой (слабой струёй). При попадании в желудочно-кишечный тракт твердого вещества или концентрированных растворов необходимо промыть желудок пострадавшего 0,1 % раствором марганцовки, дать выпить пострадавшему солевое слабительное — сульфат магния 1—2 ложки, вызвать рвоту, дать мочегонное. Кроме того, попадание в рот и желудок безводного вещества может вызвать термические ожоги.
Слабые растворы сульфата меди при приёме внутрь действуют как сильное рвотное средство и иногда применяются для провоцирования рвоты.
При работе с порошками и пылью сульфата меди(II), следует соблюдать осторожность и не допускать их пыления, необходимо использовать маску или респиратор, а после работы вымыть лицо. Острая токсическая доза при вдыхании аэрозоля — 11 мг/кг [9] . При попадании сульфата меди через дыхательные пути в виде аэрозоля нужно вывести пострадавшего на свежий воздух, прополоскать рот водой и промыть крылья носа.
Хранить вещество следует в сухом прохладном месте, в плотно закрытой жесткой пластиковой или стеклянной упаковке, отдельно от лекарств, пищевых продуктов и кормов для животных, в недоступном для детей и животных месте.




