Водоро́дный показа́тель, pH (лат. pondus Hydrogenii [1] — «вес водорода»; произносится «пэ-аш») — мера активности (в очень разбавленных растворах она эквивалентна концентрации) ионов водорода в растворе, количественно выражающая его кислотность. Равен по модулю и противоположен по знаку десятичному логарифму активности водородных ионов, выраженной в молях на один литр:
pH = − lg [ H + ] <displaystyle <mbox
ight]>
Содержание
История [ править | править код ]
Это понятие было введено в 1909 году датским химиком Сёренсеном. Показатель называется pH, по первым буквам латинских слов potentia hydrogeni — сила водорода, или pondus hydrogeni — вес водорода. Вообще в химии сочетанием pX принято обозначать величину, равную −lg X . Например, силу кислот часто выражают в виде pKa = −lg Ka .
В случае pH, буква H обозначает концентрацию ионов водорода (H + ), или, точнее, термодинамическую активность гидроксоний-ионов.
Уравнения, связывающие pH и pOH [ править | править код ]
Вывод значения pH [ править | править код ]
В чистой воде концентрации ионов водорода ([H + ]) и гидроксид-ионов ([OH − ]) одинаковы и при 22 °C составляют по 10 −7 моль/л, это напрямую следует из определения ионного произведения воды, которое равно [H + ] · [OH − ] и составляет 10 −14 моль²/л² (при 25 °C).
Когда концентрации обоих видов ионов в растворе одинаковы, говорят, что раствор имеет нейтральную реакцию. При добавлении к воде кислоты концентрация ионов водорода увеличивается (на самом деле увеличивается не концентрация собственно ионов — иначе как способность кислот «присоединять» ион водорода могла бы приводить к этому — а концентрация именно таких соединений с «присоединённым» к кислоте ионом водорода), а концентрация гидроксид-ионов соответственно уменьшается, при добавлении основания — наоборот, повышается содержание гидроксид-ионов, а концентрация ионов водорода падает. Когда [H + ] > [OH − ], говорят, что раствор является кислотным, а при [OH − ] > [H + ] — осно́вным.
Для удобства представления, чтобы избавиться от отрицательного показателя степени, вместо концентрации ионов водорода используют её взятый с обратным знаком десятичный логарифм, который, собственно, и является водородным показателем — pH.
pH = − lg [ H + ] <displaystyle < ext
ight]>
pOH [ править | править код ]
Несколько меньшее распространение получила обратная pH величина — показатель осно́вности раствора, pOH, равная отрицательному десятичному логарифму концентрации в растворе ионов OH − :
как в любом водном растворе при 25 °C [ H + ] [ OH − ] = 1 , 0 ⋅ 10 − 14 <displaystyle [< ext
pOH = 14 − pH <displaystyle < ext
Значения pH в растворах различной кислотности [ править | править код ]
| Вещество | pH | Цвет индикатора |
|---|---|---|
| Геотермальная вода у вулкана Даллол | ≈ 0 | |
| Электролит в свинцовых аккумуляторах | [2] | |
| Чистая вода при 25 °C | 7,0 | |
| Кровь | 7,36–7,44 | |
| Морская вода | 8,0 | |
| Мыло (жировое) для рук | 9,0–10,0 | |
| Нашатырный спирт | 11,5 | |
| Отбеливатель (хлорная известь) | 12,5 | |
| Концентрированные растворы щелочей | >13 |
Так как при 25 °C (стандартных условиях) [H + ] · [OH − ] = 10 −14 , то понятно, что при этой температуре pH + pOH = 14.
Так как в кислотных растворах [H + ] > 10 −7 , то у кислотных растворов pH 7, pH нейтральных растворов равен 7. При более высоких температурах константа электролитической диссоциации воды повышается, соответственно увеличивается ионное произведение воды, поэтому нейтральной оказывается pH + , так и OH − ); при понижении температуры, напротив, нейтральная pH возрастает.
Методы определения значения pH [ править | править код ]
Для определения значения pH растворов широко используют несколько методик. Водородный показатель можно приблизительно оценивать с помощью индикаторов, точно измерять pH-метром или определять аналитически путём, проведением кислотно-осно́вного титрования.
- Для грубой оценки концентрации водородных ионов широко используются кислотно-осно́вные индикаторы — органические вещества-красители, цвет которых зависит от pH среды. К наиболее известным индикаторам принадлежат лакмус, фенолфталеин, метиловый оранжевый (метилоранж) и другие. Индикаторы способны существовать в двух по-разному окрашенных формах — либо в кислотной, либо в осно́вной. Изменение цвета каждого индикатора происходит в своём интервале кислотности, обычно составляющем 1-2 единицы.
- Для расширения рабочего интервала измерения pH используют так называемый универсальный индикатор, представляющий собой смесь из нескольких индикаторов. Универсальный индикатор последовательно меняет цвет с красного через жёлтый, зелёный, синий до фиолетового при переходе из кислотной области в осно́вную. Определения pH индикаторным методом затруднено для мутных или окрашенных растворов.
- Использование специального прибора — pH-метра — позволяет измерять pH в более широком диапазоне и более точно (до 0,01 единицы pH), чем с помощью индикаторов. Ионометрический метод определения pH основывается на измерении милливольтметром-ионометром ЭДС гальванической цепи, включающей специальный стеклянный электрод, потенциал которого зависит от концентрации ионов H + в окружающем растворе. Способ отличается удобством и высокой точностью, особенно после калибровки индикаторного электрода в избранном диапазоне рН, позволяет измерять pH непрозрачных и цветных растворов и потому широко используется.
- Аналитический объёмный метод — кислотно-осно́вное титрование — также даёт точные результаты определения кислотности растворов. Раствор известной концентрации (титрант) по каплям добавляется к исследуемому раствору. При их смешивании протекает химическая реакция. Точка эквивалентности — момент, когда титранта точно хватает, чтобы полностью завершить реакцию, — фиксируется с помощью индикатора. Далее, зная концентрацию и объём добавленного раствора титранта, вычисляется кислотность раствора.
- Влияние температуры на значения pH
0,001 моль/л HCl при 20 °C имеет pH=3, при 30 °C pH=3 [ источник не указан 1238 дней ]
0,001 моль/л NaOH при 20 °C имеет pH=11,73, при 30 °C pH=10,83 [ источник не указан 1238 дней ]
Влияние температуры на значения pH объясняется различной диссоциацией ионов водорода (H + ) и не является ошибкой эксперимента. Температурный эффект невозможно компенсировать за счет электроники pH-метра.
Роль pH в химии и биологии [ править | править код ]
Кислотность среды имеет важное значение для множества химических процессов, и возможность протекания или результат той или иной реакции часто зависит от pH среды. Для поддержания определённого значения pH в реакционной системе при проведении лабораторных исследований или на производстве применяют буферные растворы, которые позволяют сохранять практически постоянное значение pH при разбавлении или при добавлении в раствор небольших количеств кислоты или щёлочи.
Водородный показатель pH широко используется для характеристики кислотно-осно́вных свойств различных биологических сред.
Кислотность реакционной среды особое значение имеет для биохимических реакций, протекающих в живых системах. Концентрация в растворе ионов водорода часто оказывает влияние на физико-химические свойства и биологическую активность белков и нуклеиновых кислот, поэтому для нормального функционирования организма поддержание кислотно-осно́вного гомеостаза является задачей исключительной важности. Динамическое поддержание оптимального pH биологических жидкостей достигается благодаря действию буферных систем организма.
В человеческом организме в различных органах водородный показатель различен. Нормальный рН крови составляет 7,36, то есть кровь имеет слабоосновную реакцию (с колебаниями от 7,34 у венозной крови до 7,40 у артериальной). В зависимости от биохимических изменений в крови может наблюдаться ацидоз (увеличение кислотности) или алкалоз (увеличение осно́вности), однако совместимый с жизнью диапазон pH крови невелик, поскольку уже при уменьшении pH до 6,95 наступает потеря сознания, а смещение реакции крови в щелочную сторону до pH = 7,7 вызывает тяжелейшие судороги. Поддержание кислотно-основного баланса крови в допустимых пределах осуществляется буферными системами крови, главной из которых является гемоглобиновая [3] . Нормальный водородный показатель желудочного сока (в просвете тела желудка натощак) равен 1,5…2,0 [4] . У сока тонкой кишки pH в норме составляет 7,2…7,5, при усилении секреции достигает 8,6. У сока толстой кишки в норме pH равен 8,5…9,0 [5] .
Водородный показатель (или уровень pH) — это показатель кислотно-щелочных свойств воды. Уровень pH является одним из важнейших индикаторов, который служит, для:
- Определения коррозионных и накипеобразующих свойств питьевой воды;
- Прогнозирования биологических и химических процессов, в питьевой воде.

В зависимости от уровня pH, поверхностные, грунтовые, и водопроводную воду можно разделить на 7 групп:
- Сильнокислая: 9,5
В соответствии с санитарно-эпидемиологическими правилами и нормативами (СанПиН), показатель pH питьевой воды может варьироваться в диапазоне от 6 до 9.
Мосводоканал подаёт в дома москвичей питьевую воду с нейтральным уровнем pH, колеблющемся в диапазоне 7 — 7,5.
Уровень pH воды в московском водопроводе регулируется на очистных станциях и контролируется сотрудниками Мосводоканала.
Поэтому проблема с высоким или низким уровнем pH питьевой воды практически не затрагивает жителей мегаполиса, но может беспокоить владельцев загородных домов и коттеджей, использующих грунтовые воды в качестве основного источника водоснабжения.
Уровень pH грунтовых вод может изменяться под влиянием различных факторов, включая, но не ограничиваясь влиянием:
Несмотря на то, что уровень кислотности и щёлочности питьевой воды не оказывает прямого влияния на здоровье человека, контроль pH имеет важное значение в процессе очистки питьевой воды. Необходимость систематического контроля уровня pH обусловлена тем, что при изменении pH изменяются другие показатели качества воды.
Своевременное выявление отклонения уровня pH от нормальных значений, позволяет своевременно предпринять меры для сохранения приемлемого качества воды, используемой в питьевых, хозяйственно-бытовых, или промышленных целях.
Если вы столкнулись с проблемой высокого или низкого уровня pH воды, в этом обзоре вы найдете ключевую информацию о прямой и опосредованной связи между уровнем pH и качественными характеристиками воды.
Если в этом обзоре нет ответа на ваш вопрос об уровне pH воды, вы можете задать его по емэйлу. Обратите внимание, что ответ на ваш вопрос будет отправлен вам на емэйл, а также опубликован в продолжении этого обзора.
Перед тем как задать свой вопрос о показателе pH водопроводной или грунтовых вод, убедитесь пожалуйста в том, что возможные пути решения вашей проблемы ещё не раскрыты в этом обзоре.
Влияет ли уровень pH питьевой воды на здоровье?
Очень высокий, или очень низкий уровень pH воды не оказывает прямых неблагоприятных последствий для здоровья человека. Но вода с повышенным уровнем pH, может вызывать зуд, раздражение, и покраснение слизистых оболочек и/или кожного покрова.
Обычно, покраснение глаз и кожный зуд наблюдаются после посещения бассейнов, в которых уровень pH воды не контролируется, либо такому контролю уделяется недостаточно внимания.
Более опасным является косвенное влияние уровня pH на:
- Химические показатели качества воды.
- Микробиологические характеристики воды.
Как уровень pH может влиять на качество воды?
При низком уровне pH (повышенная кислотность) — усиливается агрессивное влияние воды на металл, и увеличивается интенсивность коррозии внутренних стенок металлического трубопровода.
- Из-за активной коррозии металлической трубы, в воду попадают не только частички ржавчины, но и растворённые металлы, которые повышают общее содержание свинца, меди, железа в питьевой воде.
- При регулярном потреблении воды, загрязнённой металлами, токсичные металлы накапливаются в организме и создают потенциальные риски для здоровья.
Из-за колебания уровня pH в питьевой воде, на стенках труб может формироваться биоплёнка, состоящая из сообщества микроорганизмов (бактерий).
При взаимодействии биоплёнки с материалом трубы и побочными продуктами коррозии, создаются микросреды, которые влияют на микробиологические и химические характеристики воды.
- При проведении лабораторного анализа воды с высоким уровнем pH, в ней могут обнаруживаться цисты бактерий, которые не способны причинить серьёзный вред здоровью, но могут вызывать желудочно-кишечные расстройства.
- Также, из высокого уровня pH мутность питьевой воды может повышаться, и при отстаивании такой воды, может формироваться осадок.
Как изменить уровень pH в воде?
Суточные и сезонные колебания рН могут оказывать влияние на стабильность реагентов, используемых для обеззараживания воды. Выбор способа понижения или повышения показателя pH зависит от того, для каких целей будет использоваться вода.
- Для баланса уровня pH воды в бассейнах, используются химические реагенты на основе каустической соды (pH+) или бисульфата натрия (pH-).
- Для корректировки уровня pH сточных вод используются щелочные реагенты, например, на основе гидроксида натрия.
На водоочистных станциях, выбор метода коррекции уровня pH зависит от причины его изменения. Например, при использовании обеззараживающих хлорсодержащих средств, в питьевой воде может повыситься концентрация хлорид-иона, который сдвигает показатель pH в сторону повышенной кислотности.
В таких случаях, уровень pH следует регулировать на этапах очистки воды, во время которых уровень pH отклоняется от нейтральных значений.
В домашних условиях уровень pH питьевой воды можно регулировать с помощью фильтров для воды, укомплектованных специальными картриджами.
- Для повышения уровня pH используются картриджи-минерализаторы (в т.ч. Pentek GS-10CAL/RO), которые повышают уровни минералов в питьевой воде, и таким образом сдвигают баланс pH в сторону щёлочности.
- Для снижения уровня pH, используются мембраны обратного осмоса (в т.ч. Filmtec TW30-1812-50), которые снижают уровни минералов в воде, и таким образом сдвигают баланс pH в сторону кислотности.
Как часто необходимо измерять уровень pH?
Жителям Москвы и Подмосковья, которые подключены к централизованной системе водоснабжения, измерять уровень pH не требуется. Мосводоканал проводит регулярный мониторинг всех важных показателей качества воды, и публикует полученные данные на официальном сайте.
Для автономных систем водоснабжения рекомендован периодический анализ воды, в котором измеряются сразу несколько качественных характеристик, включая уровень pH.
- Если водозабор подземных вод проводится в экологически благополучных районах, рекомендованная периодичность лабораторного анализа грунтовых вод составляет 1 раз в год.
- Если частные дома и коттеджи расположены близ нефтеперерабатывающих комплексов, металлургических заводов, или предприятий, регулярно сбрасывающих сточные воды (автомойки, сельхозпредприятия) — мониторинг уровня pH и других показателей качества воды рекомендуется проводить каждые 6 месяцев.
Как все мы помним из школьного курса химии, pH – это единица активности иона водорода, равная обратному логарифму активности водородных ионов. Таким образом, вода с показателем рН, равным 7, имеет 10 -7 моль на литр ионов водорода, а вода с рН 6 – 10 -6 моль на литр. Шкала значений рН может варьировать в диапазоне от 0 до 14.
В целом вода с pH меньше 7 считается кислой, а с рН больше 7 – щелочной. Нормальный диапазон pH для поверхностных водных систем лежит в пределах от 6,5 до 8,5, а для подземных систем – от 6 до 8,5.

Значение pH воды (H20) равно 7 при 25 °C , но при контакте с диоксидом углерода в атмосфере это равновесие смещается к pH — приблизительно 5,2. Из-за тесной связи pH с атмосферными газами и температурой настоятельно рекомендуется, чтобы вода была проверена как можно быстрее. Ведь pH воды не является мерой устойчивости кислой или щелочной реакции и не дает полной картины характеристик или повода для ограничения водоснабжения.
Мягкая вода
В целом вода с низким pH (меньше 6,5) является кислой, мягкой и коррозивной. Таким образом, в воду могут проникать ионы металлов, таких как: железо, марганец, медь, свинец и цинк из водоносного горизонта, сантехники и трубопроводов. Поэтому вода с низким pH может:
- содержать повышенные уровни токсичных металлов;
- привести к преждевременному повреждению металлических труб;
- иметь металлический или кислый привкус;
- окрашивать белье;
- иметь характерное "сине-зеленое" окрашивание раковины и стоков.
Основной способ решения проблемы низкого pH воды является использование нейтрализатора. Он подает раствор в воду, чтобы предотвратить реакцию воды с домашним водопроводом или электролитическую коррозию. Типичный нейтрализатор – химическая кальцинированная сода. Нейтрализация этим средством увеличивает содержание натрия в воде.

Жесткая вода
Вода с pH выше 8,5 является жесткой. Она не представляет опасности для здоровья, но может вызвать эстетические проблемы. Эти проблемы включают в себя:
- Формирование "шкалы" или осадка на трубопроводах и светильниках.
- Щелочной привкус в воде, который может сделать вкус кофе горьким.
- Образование накипи на посуде, стиральной машине, бассейнах.
- Сложность в получении пены из мыла и моющих средств и образование нерастворимых осадков на одежде и т. д.
- Уменьшение эффективности электрических водонагревателей.
Как правило, эти проблемы возникают, когда жесткость варьируется в пределах от 100 до 200 миллиграмм CaCO3/л, что эквивалентно 12 граммам на галлон. Вода может быть смягчена за счет использования ионного обмена или добавлением золы, известково-содовой смеси, но оба процесса увеличивают содержание натрия в воде.
PH питьевой воды

Пристальное внимание к контролю pH необходимо на всех этапах водоподготовки для обеспечения удовлетворительного качества и обеззараживания воды. Хотя pH воды обычно не имеет прямого влияния на потребителей, это один из самых важных эксплуатационных параметров качества воды. Для эффективной дезинфекции с хлором показатель pH предпочтительно должен быть меньше, чем 8. PH воды на входе в систему распределения необходимо контролировать, чтобы свести к минимуму коррозию труб. Невыполнение этого требования может привести к загрязнению питьевой воды и неблагоприятным последствиям для ее вкуса, запаха и внешнего вида.
Оптимальное значение pH будет варьироваться для разных материалов в зависимости от состава воды и природы строительных материалов, используемых в системе распределения, но чаще всего оно лежит в диапазоне 6,5-9,5. Экстремальные значения pH могут быть результатом случайных разливов, поломок на очистных сооружениях.
Идеальный уровень pH ионизированной воды для долгосрочного употребления человеком находится между 8,5 и 9,5 (и никогда не превышает 10,0) с идеальным значением ОВП около 200mV-300mV (и ни в коем случае не выше 400mV).
PH воды в бассейне

Как уже упоминалось выше, pH – важнейшая характеристика не только для питьевой воды, но и для бассейнов, поскольку для дезинфекции воды все еще в основном применяют хлорирование, а при использовании хлора эффективность дезинфекции сильно зависит от исходного значения pH воды.
Хлор является основным дезинфицирующим агентом для предупреждения развития инфекций в общественных бассейнах, но хлор также реагирует с органическими веществами в воде и образует побочные продукты дезинфекции (ППД): органические вещества – производное гуминовых веществ, образующихся в результате взаимодействия воды с потом, мочой, волосами, клетками кожи и остатками средств личной гигиены, попадающих в воду от пловцов. Содержание ППД может быть измерено в виде суммы всех галогенированных соединений. Некоторые ППД увеличивают риск развития астмы, являются канцерогенами или раздражают глаза и кожу.
Хлор является общим названием хлористой кислоты, которая образует газообразный хлор, реагирующий с водой. Растворяясь в воде, кислота образует гипохлорит и имеет значение рКа, равное 7,5.
Хлористая кислота является гораздо более эффективной, чем гипохлорит, убивая бактерии, цисты, споры и неактивные вирусные. Таким образом, если значение pH в плавательном бассейне находится на нижнем уровне регулируемого диапазона, меньшее количество хлора необходимо получить для той же степени дезинфекции, а следовательно, в воде образуется меньше потенциально опасных ППД. Как показывают многочисленные исследования, оптимальный уровень pH воды в бассейне лежит в пределах от 7,5 до 8,0. При снижении pH всего на 1-0,5 единицы (до 7,0-6,5) значительно повышается уровень ППД, которые к тому же еще и геннотоксичны.
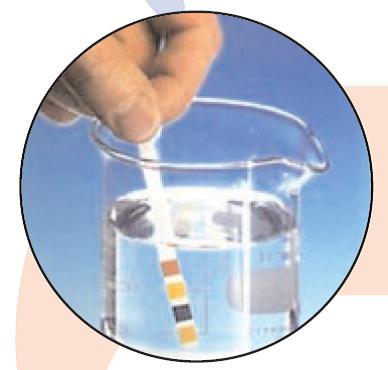
Методы определения pH
Шкала pH является логарифмической шкалой, что означает, что каждое увеличение или уменьшение на 1 единицу представляет собой изменение с коэффициентом 10. Например, раствор с pH 11 в 10 раз более щелочной, чем раствор с pH 10. Существует несколько методов, как определить pH воды.
Определение pH с помощью тест-полосок
Тест-полоски представляют собой лакмусовую бумагу, реагирующую изменением цвета на колебания pH. Приобрести их можно в зоомагазинах, поскольку часто их используют для определения pH воды в аквариумах (даже незначительное колебание этого показателя может привести к гибели рыб).

При контакте с водой цвет тест-полоски изменится. Вам придется только лишь сравнить итоговый цвет с образцом цветовой шкалы на упаковке и получить конкретное значение. Этот метод определения pH быстр, прост, дешев, но имеет достаточно большую погрешность.
Лакмусовая бумага «Роттингер»
Приобрести лакмусовые бумажки в магазинах медтехники вашего города. Проведя анализ различных ph тестов (начиная от дешевых китайских и заканчивая дорогими голландскими), мы пришли к выводу, что минимальную погрешность в показании дают немецкие ph полоски «Роттингер». В упаковке идет индикаторная шкала от 1 до14 (максимальный доступный интервал!) и 80 ph полосок, которых хватает на долгое время. С помощью данных полосок можно измерить не только ph воды, но и ph таких биологических жидкостей, как слюна, моча и тд. Так как хорошие ph метры достаточно дорогие (около 3000руб), и для них приходится покупать буферные растворы для калибровки , то лакмусовая бумага «Роттингер» , цена которой не превышает 250-350 руб., послужит вам незаменимым помощником в точном определении уровня ph.

Определение pH с помощью pH-метра
В пластиковый или стеклянный стаканчик отбирают пробу воды (20-30 мл). Датчик прибора ополаскивают небольшим количеством дистиллированной воды, а затем погружают в раствор вместе с датчиком температуры. Шкала прибора показывает вам точное значение pH исследуемого раствора. При этом следует учитывать, что на точность измерений влияет регулярная калибровка прибора, для которой используют стандартные растворы с известной величиной pH. Этот метод определения pH точен, прост, быстр, но требует больших материальных затрат по сравнению с предыдущим и простейших навыков работы с лабораторным оборудование и химическими растворами.
Таким образом, pH воды – это не просто термин из школьного курса химии, но и показатель качества воды, который должен контролироваться во избежание возникновения проблем с оборудованием и здоровьем.

