Молярная масса аммиака
Молекула аммиака имеет форму тригональной пирамиды (dNH = 0,10 нм, угол HNH равен 107,3 0 ) согласно методу валентных связей, это отвечает sp 3 -гибридизации валентных орбиталей атома азота (рис. 1). Аммиак хорошо растворим в воде: один объем воды растворяет при комнатной температуре около 700 объемов аммиака. Концентрированный раствор содержит 25% (масс.) NH3 и имеет плотность 0,91 г/см 3 .Раствор аммиака в воде называют нашатырным спиртом.
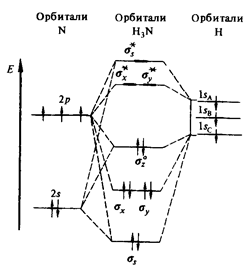
Рис. 1. Энергетическая диаграмма орбиталей молекулы аммиака.
Брутто-формула аммиака – NH3. Как известно, молекулярная масса молекулы равна сумме относительных атомных масс атомов, входящих в состав молекулы (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел).
Mr(NH3) = 14 + 3×1= 14 + 3 = 17.
Молярная масса (М) – это масса 1 моль вещества. Легко показать, что численные значения молярной массы М и относительной молекулярной массы Mr равны, однако первая величина имеет размерность [M] = г/моль, а вторая безразмерна:
Это означает, что молярная масса аммиака равна 17 г/моль.
Примеры решения задач
| Задание | Составьте формулу соединения железа с серой, если соотношение масс элементов в нём m(Fe):m(S) = 7:4. |
| Решение | Для того, чтобы узнать, в каких отношениях находятся химические элементы в составе молекулы необходимо найти их количество вещества. Известно, что для нахождения количества вещества следует использовать формулу: |
Найдем молярные массы железа и серы (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел). Известно, что M = Mr, значит (S) = 32 г/моль, а М(Fe) = 56 г/моль.
Тогда, количество вещества этих элементов равно:
n (S) = 4 / 32 = 0,125 моль.
n (Fe) = m (Fe) / M (Fe);
n (Fe) = 7 / 56 = 0,125 моль.
Найдем мольное отношение:
n(Fe) :n(S) = 0,125: 0,125 = 1:1,
т.е. формула соединения меди с кислородом имеет вид FeS. Это сульфид железа (II).
| Задание | Рассчитайте массу 2 моль газа водорода и число молекул в этом количестве вещества. |
| Решение | Запишем формулу для вычисления количества вещества: |
Тогда, массу вещества можно будет рассчитать, как:
Найдем молярную массу молекулярного водорода (значение относительной атомной массы, взятое из Периодической таблицы Д.И. Менделеева, округлим до целого числа). Известно, что M = Mr, значит (H2) = 2×Ar(H) = 2×1 = 2 г/моль.
Определим массу 2 моль газа водорода:
Число молекул обозначается N и рассчитывается по формуле:
Это безразмерная величина. Найдем число молекул азота в 2 моль этого вещества:
N (H2) = 2 × 6,023×10 -23 = 12,046×10 -23 молекул.
Аммиак – это летучее водородное соединение (нитрид водорода), которое играет ведущую роль в современной промышленности.
Хоть его и открыли лишь в восемнадцатом веке, но он был известен человеку с незапамятных времен. Водный раствор аммиака – это нашатырный спирт. Данное вещество содержится в продуктах разложения живых организмов и моче. Поэтому при распаде органики (останков растений, животных) выделяется аммиак, и от этого появляется резкий запах гниения (нашатыря).
История аммиака

Аммиак был открыт в конце восемнадцатого века британским химиком Джозефом Пристли – одним из основоположников современной химии, который совершил также множество важных открытий в других сферах науки (физике, биологии, оптике).
Например, в списках его изобретений есть: газированная вода, за которую он получил медаль Лондонского Королевского общества, и всем известный ластик (раньше для стирания графита все пользовались хлебом).
Нельзя отрицать того, что Джозеф Пристли сделал огромный вклад в химию, особенно в области газов, однако многие свои достижения он совершил случайно.
Джозеф Пристли получил аммиак методом нагревания хлорида аммония (нашатырь) с гидроксидом кальция (гашеная известь) и затем собрал выделившийся газ в ртутной ванной.
Ртутная ванная – это специальный прибор, созданный Пристли для концентрирования газов. При комнатной температуре ртуть является жидкостью с высокой плотностью, что не позволяет ей абсорбировать газы. Их ученый легко выделял из веществ, нагревая над поверхностью ртути.
После открытия Джозефом Пристли аммиака, его изучение не стояло на месте.
В 1784 был установлен состав этого вещества химиком Луи Бертолле, который разложил его на исходные элементы электрическим разрядом.
Именование "нашатырь" он получил уже в 1787 году от латинского названия нашатырной щелочи, а само наименование "аммиак", которым мы привыкли пользоваться, ввел Яков Дмитриевич Захаров в 1801 году.
Но вот что интересно. За сто лет до Джозефа Пристли и его открытия аммиака, ученый Роберт Бойль наблюдал некое явление, при котором палочка, предварительно смоченная в соляной кислоте, начинала дымить, когда ее подносили к газу, выделяющемуся при сжигании навоза. Это объясняется тем, что кислота и аммиак вступали в реакцию, и в ее продуктах содержался хлорид аммония, частицы которого и создавали дым. Получается, что экспериментальными методами аммиак был выявлен давно, но его нахождение в мире было доказано намного позже.
Состав молекулы
Молекула аммиака (NH3) имеет форму тетраэдра с атомом азота в вершине. В ней находятся четыре электронных облака, которые перекрываются вдоль линии связи, следовательно, в молекуле содержатся исключительно сигма-связи. По сравнению с водородом азот имеет большую электроотрицательность, поэтому общие электронные пары в молекуле смещены в его сторону. И так как в аммиаке везде одинарные связи, то тип гибридизации – sp 3 , а угол между электронными облаками равен 109 градусам.
Способы получения

В мире ежегодно производится около 100 миллионов тонн аммиака, поэтому этот процесс можно по праву считать одним из важнейших в мире. Выпускают его в жидком виде или как двадцати пяти процентный раствор.
Существуют следующие способы его получения:
1. В промышленности аммиак добывают посредством синтеза азота и водорода, что сопровождается выделением тепла. Причем данная реакция может проходить лишь при высокой температуре, давлении и в присутствии катализатора, который, ускоряя слабую реакцию, сам в нее не вступает.
Уравнение реакции аммиака:
2. Можно получить аммиак во время коксования каменного угля.
На самом деле в угле нет никакого аммиака, но в нем присутствует много органических соединений, в составе которых содержатся азот и водород. А при сильном нагревании угля (пиролизе) эти составляющие и образуют аммиак, который выходит как побочный продукт.
3. В лаборатории аммиак добывают нагреванием хлорида аммония и гидроксида кальция:
4. Или нагреванием хлорида аммония с концентрированной щелочью:
Применение

Аммиак – это незаменимое и действительно нужное вещество, без которого мировая промышленность замедлила бы свое движение. Область его применения широка: он задействован во всех производственных процессах человека, начиная от заводов и лабораторий, заканчивая медициной. Его преимущества в том, что он экологически чист и является довольно дешевым продуктом.
Области применения аммиака:
- Химическая промышленность. Его используют в производстве удобрений, полимеров, азотной кислоты, взрывчатых веществ, в качестве растворителя (жидкий аммиак).
- Холодильные установки. Аммиак испаряется с поглощением большого количества тепла из окружающей среды, так как обладает определенными термодинамическими свойствами. Холодильные системы, основанные на его применении более чем эффективны, поэтому он является главным хладагентом в промышленности.
- Медицина. Нашатырный спирт или 10 % раствор аммиака используют при выведении из обморочного состояния (раздражение рецепторов слизистой оболочки носа способствует стимуляции дыхания), обработке рук хирурга, возбуждении рвоты и так далее.
- Текстильная промышленность. С его помощью получают синтетические волокна. Также аммиак используют при очистке или окрашивании различных тканей.
Физические свойства
Вот какие физические свойства присущи аммиаку:
- При нормальных условиях является газом.
- Бесцветный.
- Имеет резкий запах.
- Ядовит и очень токсичен.
- Очень хорошо растворим в воде (один объем воды на семьсот объемов аммиака) и ряде органических веществ.
- Температура плавления составляет -80 °С.
- Температура кипения – около -36 °С.
- Является взрывоопасным и горючим веществом.
- Примерно вдвое легче воздуха.
- Имеет молекулярную кристаллическую решетку, соответственно, он легкоплавкий и непрочный.
- Молярная масса аммиака равна 17 грамм/моль.
- При нагревании в кислородной среде разлагается на воду и азот.
Химические свойства аммиака

Аммиак является сильным восстановителем, так как степень окисления азота в молекуле минимальная. Он способен также к окислительным свойствам, что случается намного реже.
Реакции с аммиаком:
- С кислотами аммиак образует соли аммония, разлагающиеся при нагревании. С соляной кислотой аммиак составляет хлорид аммония, а с серной — сульфат аммония.
- С кислородом при нагревании образуется азот, а при участии катализатора (Pt) получается оксид азота.
- С водой образуется неустойчивый гидрат аммиака.
Аммиак способен проявлять щелочные свойства, поэтому при взаимодействии с водой он образует слабое основание – NH4OH. Но на самом деле такого соединения не существует, поэтому формулу следует записывать так: NH3 × H2O.
С оксидами металлов.
Соединения аммиака
Есть несколько типов сложных веществ, образующихся при взаимодействии с аммиаком:
- Соли аммония. Они образуются в результате реакций аммиака с кислотами и разлагаются при нагревании.
- Амиды. Это соли, которые получают, действуя на щелочные металлы аммиаком.
- Гидразин. Это вещество, которое получают в результате окисления аммиака гипохлоритом натрия в присутствии желатина.
- Амины. Аммиак взаимодействует с галогеноалканами в качестве реакции присоединения, образуя соли.
- Аммиакаты. С серебром и солями меди аммиак образует комплексные соли.
Биологическая роль
Аммиак — вещество, образующееся в организмах живых существ при метаболизме, являющееся в них продуктом азотистого обмена. В физиологии животных для него отведена важная роль, однако он имеет высокую токсичность для организмов и почти не содержится в них в чистом виде. Большая его часть перерабатывается печенью в безвредное вещество – мочевину или как ее еще называют карбамид.
Также он способствует нейтрализации кислот поступающих в организм с пищей, поддерживая кислотно-щелочной баланс крови.
Аммиак – это важный источник азота для растений. Главным образом они поглощают его из почвы, но это очень трудоемкий и неэффективный процесс. Некоторые растения способны накапливать азот, который содержится в атмосфере, с помощью специальных ферментов – нитрогеназов. После чего они перерабатывают азот в полезные им соединения, например, белки и аминокислоты.
Агрегатные состояния

Аммиак может находиться в разных агрегатных состояниях:
- Он присутствует в виде бесцветного газа с неприятным резким запахом в нормальных условиях.
- Также он очень хорошо может растворяться в воде, поэтому его можно хранить в виде водного раствора с определенной концентрацией. Он сжижается и становится жидкостью в результате давления и сильного охлаждения.
- Аммиак имеет твердое состояние, в котором он предстает бесцветными кубическими кристаллами.
Отравление аммиаком

Как уже выше упоминалось, аммиак – это крайне токсичное и ядовитое вещество. Его относят к четвертому классу опасности.
Отравление этим газом сопровождается нарушением многих процессов организма:
- Сначала поражается нервная система и снижается усвоение кислорода нервными клетками.
- При проникновении в глотку, затем трахею и бронхи аммиак оседает на слизистых покровах, растворяется, образуя щелочь, которая начинает пагубно действовать на организм, вызывая внутренние ожоги, разрушая ткани и клетки.
- Это вещество также оказывает разрушающее воздействие на жировые компоненты, которые в том или ином виде входят в состав всех органов человека.
- Попадают под влияние сердечно-сосудистая и эндокринная система, нарушается их работа.
После контакта с аммиаком страдает почти весь организм человека, его внутренние ткани и органы, ухудшается процесс жизнедеятельности.
Чаще всего случаи отравления этим газом происходят на химических производствах в результате его утечки, но также можно им отравиться и в домашних условиях, например, если емкость, в которой содержится нашатырный спирт, неплотно закрыта, и его пары накапливаются в помещении.
Отравление может произойти, даже когда при обморочном состоянии человеку подносят к носу тампон, смоченный в нашатыре. Если пострадавшему дать понюхать его более пяти секунд, то высок риск интоксикации, так что с нашатырным спиртом всегда следует обращаться предельно осторожно.
Симптомы отравления
Ниже перечислен ряд признаков отравления аммиаком:
- Сильный кашель, затруднение дыхания.
- Жжение в глазах, слезоточивость, болевая реакция на яркий свет.
- Жжение в полости рта и носоглотке.
- Головокружение, головная боль.
- Боли в животе, рвота.
- Снижение слухового порога.
- При более серьезном отравлении возможны: потеря сознания, судороги, остановка дыхания, острая сердечная недостаточность. Совокупность нарушений может привести пострадавшего в коматозное состояние.
Профилактика при отравлении
Первая помощь в данном случае состоит из нескольких простых действий. Сначала необходимо вынести пострадавшего на свежий воздух, промыть ему лицо и глаза проточной водой. Даже те, кто был не очень хорош в химии, со школы знают: щелочь нейтрализуется кислотой, поэтому ротовую полость и нос нужно обязательно промыть водой с добавлением лимонного сока или уксуса.
Если отравившийся потерял сознание, следует уложить его на бок на случай рвоты, а при остановке пульса и дыхания сделать массаж сердца и искусственное дыхание.
Последствия отравления

После интоксикации аммиаком человека могут ждать очень серьезные необратимые последствия. В первую очередь страдает центральная нервная система, что влечет за собой целый ряд осложнений:
- Мозг перестает полностью выполнять свои функции и начинает давать сбои, из-за этого снижается интеллект, появляются психические заболевания, амнезия, нервные тики.
- Понижается чувствительность некоторых частей тела.
- Нарушается работа вестибулярного аппарата. Из-за этого человек ощущает постоянное головокружение.
- Органы слуха начинают терять свою работоспособность, что приводит к глухоте.
- При поражении глазных покровов снижается зрение и его острота, в худшем случае пострадавшего ждет слепота.
- Наступление летального исхода. Это зависит от того, насколько концентрация газа в воздухе была высокой и сколько паров аммиака попало в организм.
Знать и соблюдать предписанные меры безопасности — значит оградить себя от риска угрозы собственной жизни или худшей участи — инвалидности, потери слуха или зрения.
Среди соединений азота с водородом особое место принадлежит аммиаку. Он является важнейшим продуктом химического производства и применяется во многих отраслях деятельности человека. В нашей статье мы ознакомимся с молярной массой аммиака и изучим его основные физические и химические свойства.
Строение молекулы
Вещество имеет формулу NH3, атомы водорода связаны с центральной частицей азота ковалентными полярными связями. Общие электронные пары сильно смещены к атому азота, поэтому молекулы представляют собой диполи. Между ними возникают слабые водородные связи, которые обуславливают прекрасную растворимость соединения в воде. Так, один ее объем может поглотить до 700 частей NH3. Молярная масса аммиака составляет 17 г/моль. Раствор вещества в воде называют нашатырным спиртом или аммиачной водой. Его применяют в медицине при обморочных состояниях, так как вдыхание паров вещества возбуждает центры дыхания в коре головного мозга.
Физическая характеристика
Газообразный аммиак почти вдвое легче воздуха, не имеет цвета. При охлаждении до -33,4 или увеличении давления он быстро сжижается, переходя в бесцветную жидкую фазу. Газ легко распознают, так как запах аммиака специфический и очень резкий.
Соединение легко растворяется в воде, образуя нашатырный спирт. При его кипячении молекулы NH3 быстро испаряются. Аммиак является токсическим веществом, поэтому все химические опыты с ним требуют проведения под вытяжкой с большой осторожностью. Вдыхание паров газа вызывает раздражение слизистой оболочки органа зрения, боль в желудке и одышку.

Гидроксид аммония
В растворе аммиачной воды присутствует три вида частиц: гидраты аммиака, анионы гидроксильных групп и катионы аммония NH4 + . Присутствие гидроксид-ионов придает раствору нашатырного спирта щелочную реакцию. Ее можно обнаружить с помощью индикаторов, например, бесцветного фенолфталеина, который в аммиачной воде становится малиновым. В процессе взаимодействия гидроксильных анионов с катионами аммония вновь образуются частицы аммиака, молярная масса которого составляет 17 г/моль, а также молекулы воды. При их взаимодействии между собой, частицы связываются водородными связями. Поэтому водный раствор вещества можно выразить формулой NH4OH, он получил название гидроксида аммония. Соединение проявляет слабые щелочные свойства.
Особенности иона NH4+
Сложный ион аммония формируется с помощью донорно-акцепторного механизма образования ковалентной связи. Атом азота выступает в роли донора и предоставляет два своих электрона, которые становятся общими. Ион водорода отдает свободную ячейку, становясь акцептором. В результате соединения катионов аммония и гидроксид-ионов появляются молекулы аммиака, запах которого ощущается сразу, и воды. Равновесие реакции смещается влево. Во многих веществах частицы аммония аналогичны положительным ионам одновалентных металлов, например, в формулах солей: NH4Cl, (NH4)2SO4 – хлориде и сульфате аммония.

Реакции с кислотами
Аммиак вступает в реакции со многими неорганическими кислотами с образованием соответствующих солей аммония. Например, в результате взаимодействия хлоридной кислоты и NH3 получим хлористый аммоний:
Это реакция присоединения. Соли аммония при нагревании разлагаются, при этом выделяется газообразный аммиак, температура кипения которого составляет -33,34 °C. Они также имеют хорошую растворимость в воде и способны к гидролизу. Соли аммония при нагревании разлагаются, при этом выделяется газообразный аммиак. Они также имеют хорошую растворимость в воде и способны к гидролизу. Если соль аммония образована сильной кислотой, то раствор ее имеет кислую реакцию. Она обусловлена избыточным количеством ионов водорода, которые можно обнаружить с помощью индикатора – лакмуса, изменяющего свою фиолетовую окраску на красную.
Как измеряется молярная масса
Если порция вещества содержит 6,02×10 23 структурных единиц: молекул, атомов или ионов, то речь идет о величине, которая называется числом Авогадро. Она соответствует молярной массе, г/моль – это единица ее измерения. Например, в 17 граммах аммиака содержится число Авогадро молекул или 1 моль вещества, а в 8,5 граммах – 0,5 моль и т. д. Молярная масса – специфическая единица, применяемая в химии. Она не равнозначна физической массе. Существует еще одна единица измерения, которая используется при химических расчетах. Это масса 1 моля эквивалента аммиака. Она равна произведению молярной массы на фактор эквивалентности. Именуется молярной массой эквивалента аммиака и имеет размерность — моль/л.

Химические свойства
Газообразный аммиак – горючее вещество. В атмосфере кислорода или горячего воздуха он сгорает с образованием свободного азота и паров воды. Если в реакции применять катализатор (платину или окись трехвалентного хрома), то продукты процесса будут другими. Это — монооксид азота и вода:
Эту реакцию называют каталитическим окислением аммиака. Она является окислительно-восстановительной, в ней аммиак, молярная масса равна 17 г/моль, проявляет сильные восстановительные свойства. Он способен также реагировать с оксидом меди, восстанавливая его до свободной меди, газообразного азота и воды. Газ может реагировать с концентрированной соляной кислотой и в отсутствии воды. Известен опыт, который называют: дым без огня. Одну стеклянную палочку погружают в нашатырный спирт, а другую – в концентрированную хлоридную кислоту, затем их сближают. Наблюдают появление белого дыма, который выделяют образующиеся мелкие кристаллы хлорида аммония. Такого же эффекта можно добиться, если поставить пробирки с двумя растворами рядом. Уравнение аммиака с хлоридной кислотой было приведено нами выше.
При сильном нагревании молекулы вещества разлагаются на свободный азот и водород:
Как распознать ион NH4+
Соли аммония реагируют не только с кислотами, но и со щелочами. В результате выделяется газообразный аммиак, что легко определяют органом обоняния. Это доказывает, что данная соль содержит ион аммония.
Более точным показателем того, что при взаимодействии щелочи и сульфата аммония выделяется катион NH4 + ,служит влажная универсальная лакмусовая бумага. Она изменяет свой цвет с красного на синий.
Промышленный синтез аммиака
Газообразное соединение добывают прямой реакцией соединения водорода, полученного конверсией из воды, и азота, выделенного из воздуха. Процесс является каталитическим (используют металлическое железо, содержащее примеси окислов калия и алюминия). При этом учитывают тот факт, что температура кипения аммиака составляет -33,4 °С. Экзотермическая реакция синтеза аммиака требует повышения давления в реагирующей газовой смеси до 450 – 460 °С. Чтобы повысить практический выход продукта в обратимой реакции синтеза аммиака, регулируют чистоту реагентов, не допускают повышения температуры в колонне синтеза.

Где применяют аммиак и его соли
Физические и химические характеристики вещества обуславливают его использование в различных сферах промышленности. Наибольшее его количество используют для синтеза нитратной кислоты, азотсодержащих солей аммония, соды по аммиачному способу, карбамида. В холодильных установках вещество применяют, благодаря его способности испаряться, одновременно поглощая избыток тепла. Аммиачную воду и жидкий аммиак используют в качестве азотного удобрения.

